La FDA approuve l'Enhertu d'AstraZeneca en première ligne dans le cancer du sein métastatique HER2
information fournie par Zonebourse 16/12/2025 à 10:01
Le feu vert de l'autorité sanitaire américaine concerne l'association d'Enhertu et du Perjeta de Roche (pertuzumab ) chez des patients adultes atteints d'un cancer du sein HER2-positif non opérable ou métastatique, tel que déterminé par un test approuvé par la FDA.
"Il s'agit du premier nouveau traitement de référence approuvé dans cette indication depuis plus de dix ans, sur la base des résultats robustes de l'étude de phase III Destiny-Breast09", réagissent ce matin les analystes d'AllInvest Securities.
Dans cet essai, la combinaison Enhertu-pertuzumab avait permis de réduire de 44% le risque de progression de la maladie ou de décès en comparaison de la thérapie standard, avec une survie sans progression médiane supérieure à trois ans (40,7 mois contre 26,9 mois).
"Ce gain d'efficacité, constant dans l'ensemble des sous-groupes, établit un nouveau standard thérapeutique dans une population où le pronostic restait limité malgré les avancées des thérapies ciblées", commente AllInvest, qui évoque une avancée clinique et commerciale "majeure" pour AstraZeneca et son partenaire Daiichi Sankyo.
D'après AstraZeneca, ce sont environ 10 000 patients qui sont touchés chaque année aux Etats-Unis par cette forme du cancer du sein.
Sur le plan financier, l'approbation de la FDA va déclencher le versement d'un paiement d'étape de 150 millions de dollars d'AstraZeneca à Daiichi Sankyo.
Le groupe biopharmaceutique a en outre annoncé ce matin avoir obtenu une autorisation de mise sur le marché de la part de l'Union européenne pour Saphnelo (anifrolumab) en administration sous-cutanée via un stylo prérempli, ce qui va permettre aux patients atteints de lupus érythémateux systémique (SLE) de bénéficier d'une option d'auto-administration hebdomadaire, en complément d'un traitement standard.
| 13 603,000 GBX | LSE | +1,06% |
A lire aussi
-
![Le militant des droits de l'homme Javier Tarazona (d) et son frère José Rafael Tarazona (g) à l'église La Candelaria, après sa libération de prison, le 1er février 2026 à Caracas, au Venezuela ( AFP / Federico PARRA )]()
Libéré dimanche après quatre ans et sept mois d'incarcération, le célèbre activiste vénézuélien Javier Tarazona appelle à la "réconciliation" lors d'un entretien exclusif à l'AFP, estimant après ses "1675 jours" de détention que chaque journée en prison est "trop ... Lire la suite
-
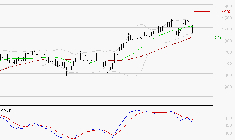
![FORVIA SE : Une consolidation vers les supports est probable]()
SYNTHESE Le MACD est positif mais inférieur à sa ligne de signal. La dynamique en cours est interrompue. Dans le cas où le MACD deviendrait négatif, le repli des cours pourrait se poursuivre. La valeur du RSI est inférieure à 50 : cela confirme la faiblesse des ... Lire la suite
-
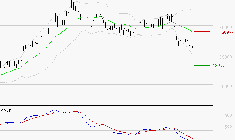
![KERING : Sous les résistances, une consolidation est probable]()
SYNTHESE Le MACD est négatif et inférieur à sa ligne de signal. Cette configuration dégrade les perspectives sur le titre. Le RSI n'indique pas encore une survente donc la poursuite de la baisse est techniquement possible. Inférieurs à 20, les stochastiques sont ... Lire la suite
-
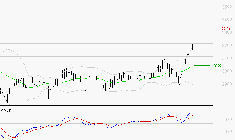
![VEOLIA ENVIRONNEMENT : Les signaux haussiers sont intacts]()
SYNTHESE Le MACD est positif et supérieur à sa ligne de signal. Cette configuration confirme la bonne orientation du titre. On constate que le potentiel de hausse du RSI n'est pas épuisé. Les stochastiques, pour leur part, se trouvent dans la zone de surachat, ... Lire la suite
Mes listes
Une erreur est survenue pendant le chargement de la liste

0 commentaire
Vous devez être membre pour ajouter un commentaire.
Vous êtes déjà membre ? Connectez-vous
Pas encore membre ? Devenez membre gratuitement
Signaler le commentaire
Fermer