Toute l'actualité économique, politique et internationale
À la une
Le Cercle des économistes
Vidéos
Netanyahu: Israël n'en "a pas encore fini" avec le pouvoir iranien
Le Premier ministre israélien Benjamin Netanyahu a affirmé mardi qu'Israël n'en "a pas encore fini" avec le pouvoir iranien. ... Lire la suite
-
Emmanuel Macron accueille mardi une quarantaine de représentants d'Etats à Paris pour le 2e sommet consacré à la relance du nucléaire civil, présenté comme un levier de souveraineté énergétique, dans un contexte marqué par la guerre au Moyen-Orient qui rappelle ... Lire la suite
-
Emmanuel Macron a convoqué un nouveau Conseil de défense et de sécurité nationale mardi à 18H30 "sur la situation en Iran et au Moyen-Orient", a annoncé l'Élysée. Le président de la République a enchaîné les réunions de crise depuis le début du conflit déclenché ... Lire la suite
-
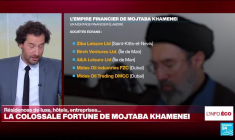
Alors que la tradition chiite impose une vie austère aux autorités religieuses, plusieurs enquêtes de presse décrivent au contraire un vaste empire financier lié au nouveau guide suprême iranien, Mojtaba Khamenei, héritier du système économique construit autour ... Lire la suite
-
Lundi, le gazole a dépassé la barre symbolique des 2 euros le litre dans l'Hexagone, un seuil inédit depuis l'été 2022. Objectif : "avancer" sur la question des prix du pétrole, dans le contexte de guerre au Moyen-Orient qui chahute les cours de l'énergie. Ce mardi ... Lire la suite
-
La guerre au Moyen-Orient est "pratiquement terminée", a assuré lundi soir le président américain Donald Trump, provoquant un soulagement sur les marchés pétroliers et financiers, même si les conditions d'un arrêt du conflit, entré mardi dans son onzième jour, ... Lire la suite
-
Le Premier ministre israélien Benjamin Netanyahu a affirmé mardi qu'Israël n'en "a pas encore fini" avec le pouvoir iranien.
-
Les exportations allemandes ont reculé davantage qu'attendu en janvier sur un mois, principalement en raison d'une baisse des ventes vers l'Union européenne et la Chine, selon un communiqué de l'office statistique publié mardi. D'après Destatis, les exportations ... Lire la suite
-
Donald Trump a assuré lundi que la guerre contre l'Iran allait "se terminer bientôt", sans préciser à quelle échéance, bien que Téhéran poursuive ses attaques de missiles et de drones dans le Golfe.
-
Le géant pétrolier saoudien Aramco a annoncé mardi une baisse de son bénéfice net de 12,1% en 2025, affecté par des hausses de production, par les droits de douane américains et d'autres facteurs économiques négatifs. Le fleuron de l'industrie saoudienne et premier ... Lire la suite
-
Le numéro un mondial du jouet, le danois Lego, a annoncé mardi des ventes et des bénéfices record pour son exercice 2025, une année "fantastique" selon son patron, malgré un environnement instable. Le groupe a dégagé l'an passé un bénéfice net en hausse de 21%, ... Lire la suite
-
L'Iran a promis mardi que plus aucune goutte de pétrole ne sortirait du Moyen-Orient "jusqu'à nouvel ordre", dans un rejet cinglant des propos de Donald Trump la veille sur une guerre "quasiment" terminée. La République islamique a estimé que les négociations avec ... Lire la suite
-
L'université Paris 1-Panthéon Sorbonne, en déficit depuis deux ans, a atteint "un point de rupture" et ne se maintient à flots que grâce au "dévouement" de son personnel, a alerté mardi sa présidente Christine Neau-Leduc. "Nous arrivons à maintenir nos missions ... Lire la suite
-
Le déficit commercial de la France s'est réduit à 3,1 milliards d'euros en janvier, une amélioration de 300 millions d'euros par rapport à décembre attribuable à une baisse des importations et une légère hausse des exportations, ont indiqué les douanes mardi. Les ... Lire la suite
-
La mesure a été approuvée par les trois organisations patronales représentatives, ainsi que par la CFDT, la CFTC et FO. 600 à 800 millions d'euros d'économies, en régime de croisière. C'est ce que devrait permettre le raccourcissement de la durée maximale d'indemnisation ... Lire la suite
-
La flambée des cours du pétrole, due à la guerre au Moyen-Orient, exacerbe l'anxiété des automobilistes et motocyclistes à travers l'Asie, nombreux à faire la queue aux stations-service face aux rationnements ou pour devancer des hausses attendues des prix à la ... Lire la suite
-
Voici les derniers événements mardi au onzième jour de la guerre au Moyen-Orient: - Netanyahu affirme qu'Israël n'en "a pas encore fini" avec le pouvoir iranien Le Premier ministre israélien Benjamin Netanyahu a affirmé mardi qu'Israël "brisait les os" du pouvoir ... Lire la suite
-
A cinq jours du premier tour des municipales, l'ex-patron de l'OL Jean-Michel Aulas clôture mardi avec un meeting sa campagne pour reprendre aux écologistes la mairie de Lyon, qu'il a menée dans le fauteuil confortable de grand favori. Candidat adoubé par la droite ... Lire la suite
-
Moins d'entretien, vie plus longue, les voitures électriques modifient le modèle économique des loueurs longue durée, a expliqué François-Xavier Castille, vice-PDG du groupe de leasing Arval, qui a annoncé mardi un résultat net 2025 en nette baisse malgré une flotte ... Lire la suite
-
Le groupe CMA Media veut réunir les rédactions numériques de son journal La Tribune et de sa chaîne télé BFM Business pour créer un pôle d'information économique commun, a-t-il annoncé lundi, quatre mois après le rejet par le personnel d'une première mouture du ... Lire la suite
-
La Caisse des dépôts (CDC) va proposer de nommer à la tête de sa filiale dédiée à l'habitat Clément Lecuivre, actuellement directeur général de CDC Habitat, en remplacement d'Anne-Sophie Grave, selon un communiqué publié lundi. Cette nomination est soumise à l'approbation ... Lire la suite
-
![]() information fournie par AFP 10:39IA : le Français Yann LeCun lève 890 millions d'euros et veut un "changement de paradigme"
information fournie par AFP 10:39IA : le Français Yann LeCun lève 890 millions d'euros et veut un "changement de paradigme"Après Meta, une nouvelle page s'ouvre pour le chercheur en intelligence artificielle Yann LeCun : la startup qu'il a cofondée a annoncé mardi avoir levé 890 millions d'euros pour accélérer la recherche de nouveaux modèles d'IA capables de comprendre le monde physique.
-
![]() information fournie par Reuters 10:39L'Europe rebondit, le reflux des cours du pétrole soulage
information fournie par Reuters 10:39L'Europe rebondit, le reflux des cours du pétrole soulageLes principales Bourses européennes rebondissent mardi en début de séance, soulagées par le reflux des prix du pétrole après que le président Donald Trump a évoqué une fin imminente de la guerre en Iran. À Paris, le CAC 40 gagne 1,68% et repasse la barre des
-
![]() information fournie par Boursorama avec LabSense 08:30Prescription fiscale : quels sont les délais ?
information fournie par Boursorama avec LabSense 08:30Prescription fiscale : quels sont les délais ?Quand on vous parle de 3/6/9, vous pensez sans doute au bail locatif. Mais connaissez-vous le “3/6/10” version fiscale ? Ce trio de chiffres correspond aux délais pendant lesquels l’administration peut remonter le temps pour vérifier, rectifier… ou rattraper un
-
![]() information fournie par Ecorama 09 marsEric Lombard : "L'inquiétude ne sert pas à grand-chose, il n'y a pas de problème d'approvisionnement en essence !"3
information fournie par Ecorama 09 marsEric Lombard : "L'inquiétude ne sert pas à grand-chose, il n'y a pas de problème d'approvisionnement en essence !"3Éric Lombard, ancien ministre de l'Economie, était l'invité de l'émission Ecorama du 9 mars 2026, présentée par David Jacquot sur Boursorama.com. Parmi les sujets abordés : l'impact économique du conflit en Iran, les risques d'inflation et de récession, la menace
-
![]() information fournie par AFP 09 marsLe gazole dépasse 2 euros le litre dans l'Hexagone1
information fournie par AFP 09 marsLe gazole dépasse 2 euros le litre dans l'Hexagone1Le gazole a dépassé lundi la barre symbolique des 2 euros le litre dans l'Hexagone, selon une moyenne calculée par l'AFP sur la base des données de quelque 9.400 stations-service transmises au gouvernement, un seuil inédit depuis l'été 2022. Depuis le 27 février,
-
![]() information fournie par Boursorama avec Newsgene 09 marsMunicipales 2026 : pouvez-vous donner de l'argent à un candidat pour financer sa campagne ?
information fournie par Boursorama avec Newsgene 09 marsMunicipales 2026 : pouvez-vous donner de l'argent à un candidat pour financer sa campagne ?Vous pouvez soutenir financièrement un candidat à l'élection municipale. Les dons sont toutefois encadrés par la loi. Seules les personnes physiques sont autorisées à verser jusqu'à 4 600 euros à un candidat. Les espèces sont limitées à 150 euros et, dans les communes
-
![]() information fournie par Boursorama avec AFP 08:26Logement social : CDC Habitat va changer de patron
information fournie par Boursorama avec AFP 08:26Logement social : CDC Habitat va changer de patronLa Caisse des dépôts (CDC) va proposer de nommer à la tête de sa filiale dédiée à l'habitat Clément Lecuivre, actuellement directeur général de CDC Habitat, en remplacement d'Anne-Sophie Grave, selon un communiqué publié lundi. Cette nomination est soumise à l'approbation
-
![]() information fournie par Swiss Life AM FR 09 marsPoint de gestion – ESG Tendances Pierre | Février 2026
information fournie par Swiss Life AM FR 09 marsPoint de gestion – ESG Tendances Pierre | Février 2026Performances, évolution de la valeur liquidative, allocation du portefeuille… Découvrez les principaux indicateurs de la société civile ESG Tendances Pierre. Ce mois-ci, ESG Tendances Pierre poursuit sa trajectoire positive avec une performance régulière et un
Articles les plus lus
Articles les plus commentés
- Accueil Bourse
- Tous les cours boursiers
- Cours CAC 40
- Indices boursiers internationaux
- Palmarès Bourse
- Cours du Pétrole (Brent)
- Convertisseur de devises
- Convertisseur dollar / euro
- Convertisseur euro / dollar
- Convertisseur livres / euro
- Convertisseur franc suisse / euro