Toute l'actualité économique, politique et internationale
À la une
Le Cercle des économistes
Vidéos
Guerre au Moyen-Orient: les derniers développements
Voici les derniers événements de la guerre au Moyen-Orient, entrée mercredi dans son douzième jour: - L'Iran revendique des frappes de grande ampleur L'Iran a mené la vague de frappes "la plus violente et la plus lourde depuis le début de la guerre", visant notamment... Lire la suite
-
L'Iran a revendiqué mercredi une offensive de grande ampleur et ciblé un champ pétrolier en Arabie saoudite, au moment où l'Agence internationale de l'énergie (AIE) envisage un recours sans précédent aux réserves stratégiques face à la flambée des cours du brut. ... Lire la suite
-
De nouvelles attaques ont visé des installations militaires américaines au Proche-Orient mercredi, après que les Etats-Unis et Israël ont pilonné l'Iran mardi lors de bombardements décrits par le Pentagone et les Iraniens comme les plus intenses menés depuis le ... Lire la suite
-
((Traduction automatisée par Reuters à l'aide de l'apprentissage automatique et de l'IA générative, veuillez vous référer à l'avertissement suivant: https://bit.ly/rtrsauto)) par Hanna Rantala Le célèbre chef Wolfgang Puck a préparé un festin de plus de 70 plats ... Lire la suite
-
Voici les derniers événements de la guerre au Moyen-Orient, entrée mercredi dans son douzième jour: - L'Iran revendique des frappes de grande ampleur L'Iran a mené la vague de frappes "la plus violente et la plus lourde depuis le début de la guerre", visant notamment ... Lire la suite
-
La Corée du Nord respecte le choix de l'Iran concernant son nouveau guide suprême, a rapporté mercredi la presse d'Etat, tout en accusant les Etats-Unis et Israël de détruire la paix régionale. "S'agissant de la récente annonce officielle selon laquelle l'Assemblée ... Lire la suite
-
Washington menace de lourdes "conséquences militaires" l'Iran, qu'il suspecte de vouloir miner le détroit d'Ormuz, axe stratégique pour le pétrole mondial. Le président américain a affirmé mardi que l'Iran s'exposait à des "conséquences militaires (...) sans précédent" ... Lire la suite
-
L'incendie d'un car à Chiètres, dans le canton suisse de Fribourg, a causé mardi la mort d'au moins six personnes et poussé la police à ouvrir une enquête criminelle. "Nous avons à ce stade des éléments laissant penser à un acte délibéré commis par une personne ... Lire la suite
-
Le président américain Donald Trump a prévenu mardi soir Téhéran de conséquences militaires d'un niveau "jamais aperçu auparavant" si des mines étaient placées dans le détroit d'Ormuz, alors que les Etats-Unis et Israël ont bombardé dans la journée l'Iran avec ... Lire la suite
-
Un autocar avec des passagers à son bord s'est embrasé mardi soir dans une petite ville du canton de Fribourg, dans l'ouest de la Suisse, faisant au moins six morts et cinq blessés, a annoncé la police cantonale, privilégiant la piste d'un "acte volontaire". Cet ... Lire la suite
-
Une vingtaine de pays réunis mardi au sommet nucléaire de Paris ont appelé à "mobiliser" les financements publics comme privés pour investir dans cette technologie qui connaît un certain retour en grâce. Parmi ces 27 pays, la France rejointe par la Belgique, le ... Lire la suite
-
Nouveau rebondissement dans l'affaire des supporters sénégalais condamnés après la finale de la CAN pour hooliganisme, qui vont devoir repasser devant le tribunal à Rabat. Le parquet et la partie civile marocains a fait appel de la décision rendue en première instance, ... Lire la suite
-
Une nouvelle vidéo analysée authentifiée et géolocalisée par plusieurs médias crédibles montre qu'un missile américain Tomahawk est tombé à proximité de l'école de Minab dans le sud de l'Iran, bombardée au premier jour de la guerre. Donald Trump a toujours assuré ... Lire la suite
-
Pugnace pour son dernier meeting, l'ex-patron de l'OL Jean-Michel Aulas a promis mardi à ses partisans une victoire contre les écologistes sortants, accusés d'avoir "gouverné par posture et par provocation". En cette fin de campagne "intense", voire "rude", le ... Lire la suite
-
A Marseille, les listes électorales comptent un nombre étonnamment élevé de "supercentenaires", âgés de plus de 110 ans et même celle qui devrait du même coup être la doyenne de l'humanité, une dame de... 120 ans. Problème: la plupart sont en réalité décédés, parfois ... Lire la suite
-
La Banque centrale européenne (BCE) fera tout son possible pour maintenir l'inflation sous contrôle, en dépit du bond des prix de l'énergie, a déclaré mardi soir la présidente de l'institution, Christine Lagarde, sur France 2. Christine Lagarde a estimé que l'Europe ... Lire la suite
-
Pierre-Yves Bournazel, candidat centre-droit à la mairie de Paris, en légère érosion dans les sondages, s'est dit "combatif" mardi en vue d'être "le plus haut possible" au premier tour, pour "poursuivre le rassemblement" au second. "Je suis très déterminé et combatif, ... Lire la suite
-
Lorsque le chef d'état-major américain, le général Dan Caine, a exprimé mardi son "respect" envers les combattants iraniens, ses remarques sont venues en contraste avec la rhétorique souvent vantarde et moqueuse affichée par Donald Trump et son gouvernement depuis ... Lire la suite
-
La justice a lancé une vaste offensive contre la DZ Mafia en plaçant en garde à vue 42 personnes, dont les principaux chefs présumés de cette organisation criminelle qui prospère autour du narcotrafic et a étendu ses activités bien au-delà de Marseille. Préparée ... Lire la suite
-
L'Ukraine a affirmé avoir mené mardi une frappe de missiles britanniques sur une usine militaire à Briansk, dans l'ouest de la Russie, les autorités russes affirmant que ce bombardement avait fait au moins six morts. Kiev mène régulièrement des attaques sur des ... Lire la suite
-
Avant son nouveau palmarès d'étoiles qui dévoilé le 16 mars à Monaco, le guide Michelin a annoncé mardi à l'AFP ses rétrogradations pour 2026, marquées par la perte d'un macaron pour Sébastien Bras, le chef étoilé qui n'en voulait plus. Coup de tonnerre cette saison, ... Lire la suite
-
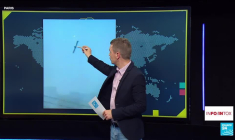
![]() information fournie par AFP 03:50Guerre au Moyen-Orient: les conséquences économiques mondiales3
information fournie par AFP 03:50Guerre au Moyen-Orient: les conséquences économiques mondiales3Voici les dernières évolutions économiques mondiales, mercredi vers 03H00 GMT, au douzième jour de la guerre au Moyen-Orient: - Une possible intervention concertée face à la flambée du pétrole L'Agence internationale de l'énergie (AIE) propose un recours sans précédent
-
![]() information fournie par AFP 02:17Dassault dévoile le Falcon 10X, jet d'affaires inspiré du Rafale
information fournie par AFP 02:17Dassault dévoile le Falcon 10X, jet d'affaires inspiré du RafaleMaître des chasseurs Rafale, le français Dassault a dévoilé le Falcon 10X, son dernier jet privé, plus rare et plus cher que ses concurrents nord-américains, mais attendu pour ses performances issues de technologies militaires dans un marché en croissance. Dans
-
![]() information fournie par Boursorama avec LabSense 10 marsPrescription fiscale : quels sont les délais ?
information fournie par Boursorama avec LabSense 10 marsPrescription fiscale : quels sont les délais ?Quand on vous parle de 3/6/9, vous pensez sans doute au bail locatif. Mais connaissez-vous le “3/6/10” version fiscale ? Ce trio de chiffres correspond aux délais pendant lesquels l’administration peut remonter le temps pour vérifier, rectifier… ou rattraper un
-
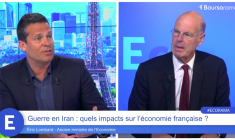
![]() information fournie par Ecorama 09 marsEric Lombard : "L'inquiétude ne sert pas à grand-chose, il n'y a pas de problème d'approvisionnement en essence !"5
information fournie par Ecorama 09 marsEric Lombard : "L'inquiétude ne sert pas à grand-chose, il n'y a pas de problème d'approvisionnement en essence !"5Éric Lombard, ancien ministre de l'Economie, était l'invité de l'émission Ecorama du 9 mars 2026, présentée par David Jacquot sur Boursorama.com. Parmi les sujets abordés : l'impact économique du conflit en Iran, les risques d'inflation et de récession, la menace
-
![]() information fournie par Boursorama avec Newsgene 10 marsPourquoi Alain-Fabien Delon suspend finalement sa demande d’annulation du testament de son père3
information fournie par Boursorama avec Newsgene 10 marsPourquoi Alain-Fabien Delon suspend finalement sa demande d’annulation du testament de son père3Alain-Fabien Delon a décidé de suspendre la procédure engagée en France pour contester le testament de son père, Alain Delon, décédé en août 2024. Ce désistement lui permet de se concentrer sur une procédure similaire en cours en Suisse. Alain-Fabien Delon, fils
-
![]() information fournie par aufeminin 10 marsFrais bancaires injustifiés à la Caisse d’Épargne : cette décision de la répression des fraudes peut vous rapporter gros
information fournie par aufeminin 10 marsFrais bancaires injustifiés à la Caisse d’Épargne : cette décision de la répression des fraudes peut vous rapporter grosPlus de 9 millions d’euros d’amendes, des commissions d’intervention jugées trompeuses : la DGCCRF vise deux Caisses d’Épargne régionales. Les clients touchés sauront-ils vraiment quels frais bancaires injustifiés pourront être remboursés ? Une ligne « commission
-
![]() information fournie par Boursorama avec Newsgene 10 marsUn couple condamné à couper sa maison en deux en raison d'une erreur sur le cadastre il y a 30 ans2
information fournie par Boursorama avec Newsgene 10 marsUn couple condamné à couper sa maison en deux en raison d'une erreur sur le cadastre il y a 30 ans2Un couple a été condamné par le tribunal judiciaire d’Angers à démolir la partie centrale de sa maison en raison d'une erreur sur le cadastre. L'extension en question a été construite dans les années 90 et n'avait jamais été remise en cause pendant plus de 20 ans.
-
![]() information fournie par Boursorama avec AFP 10 marsLogement social : CDC Habitat va changer de patron
information fournie par Boursorama avec AFP 10 marsLogement social : CDC Habitat va changer de patronLa Caisse des dépôts (CDC) va proposer de nommer à la tête de sa filiale dédiée à l'habitat Clément Lecuivre, actuellement directeur général de CDC Habitat, en remplacement d'Anne-Sophie Grave, selon un communiqué publié lundi. Cette nomination est soumise à l'approbation
Articles les plus lus
Articles les plus commentés
- Accueil Bourse
- Tous les cours boursiers
- Cours CAC 40
- Indices boursiers internationaux
- Palmarès Bourse
- Cours du Pétrole (Brent)
- Convertisseur de devises
- Convertisseur dollar / euro
- Convertisseur euro / dollar
- Convertisseur livres / euro
- Convertisseur franc suisse / euro